2024

本篇為醫械產品技術要求編寫常見問題匯總整理—第一百三十九篇。答疑匯總由于GMP中沒有明確規定常溫和陰涼的溫度定義,那醫療器械生產企業的常溫和陰涼的溫度范圍界定必須參照藥典執行嗎?可以自行根據原料特性來...
2024
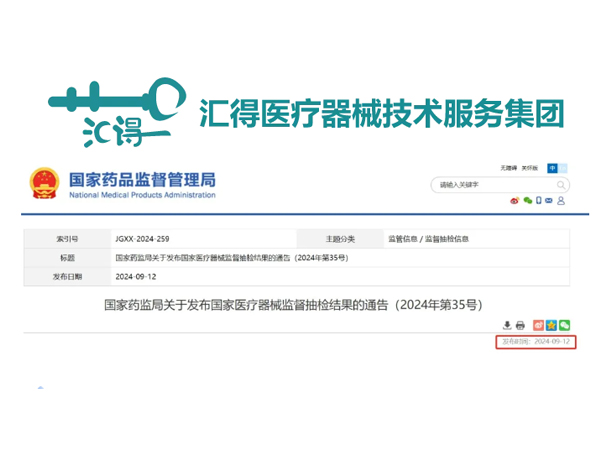
通知為加強醫療器械監督管理,保障醫療器械產品質量安全有效,國家藥品監督管理局組織對半導體激光治療機、疤痕修復凝膠等17個品種進行了產品質量監督抽檢,有24批(臺)產品不符合標準規定。具體情況通告如下:...
2024

本篇為醫械產品技術要求編寫常見問題匯總整理—第一百三十八篇。答疑匯總請問醫療器械新產品(體外診斷試劑)用于注冊檢批次能否在醫療器械生產許可證外的廠房進行?需要滿足哪些要求。申請人用于產品注冊申報的生產...
2024

《國家醫療保障局辦公室關于加強區域協同做好2024年醫藥集中采購提質擴面的通知》(下稱《醫藥集采通知》)中提出,將“深入推進高值醫用耗材集中采購。”,并且國家醫保局將重點指導七省全國聯采高值耗材工作,...
2024

本篇為醫械產品技術要求編寫常見問題匯總整理—第一百三十七篇。答疑匯總想咨詢一下醫療器械新產品(體外診斷試劑)用于注冊檢批次是否允許在醫療器械生產許可證外的廠房進行?如果可行,我們需要滿足哪些要求。申請...
2024
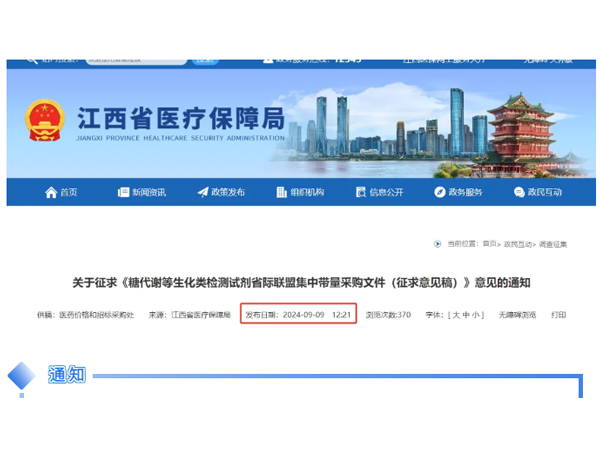
通知各有關單位:根據《國家醫療保障局辦公室關于加強區域協同做好2024年醫藥集中采購提質擴面的通知》(醫保辦發〔2024〕8號)有關要求,我局牽頭開展糖代謝等生化類檢測試劑聯盟集采,成立了包括天津市、...
2024

本篇為醫械產品技術要求編寫常見問題匯總整理—第一百三十六篇。答疑匯總擬申報的第二類體外診斷試劑屬于《免于臨床試驗體外診斷試劑目錄》的產品,適用樣本類型除血清、血漿、全血外,還有末梢全血(指尖血)。那針...
2024

北京藥監在 8 月 29 日發布通告,將于2024年9月1日啟用新版許可系統辦理第三類醫療器械經營首次許可等 12 個行政許可及備案事項,為企業提供更便捷的申報渠道。本通告為醫療器械企業發展創造更有利...
2024

本篇為醫械產品技術要求編寫常見問題匯總整理—第一百三十四篇。答疑匯總中頻治療儀產品中,通過按鍵控制強度、溫度、時間等參數,通過液晶顯示屏顯示參數的簡單的控制程序是否算是軟件?如果是軟件應當算什么類別,...
2024

本篇為醫械產品技術要求編寫常見問題匯總整理—第一百三十三篇。答疑匯總注冊可以參考過期但未延續的同類產品相關臨床評價資料進行申報注冊嗎?是否可以免于臨床試驗,提交臨床評價?(1) 該擬選定同品種產品雖然...
